의약품 개발의 임상 단계는 여러 과정을 거쳐 약품의 안전성과 효과를 검증합니다. 이 과정은 사전 연구, 임상시험 1~3상, 승인 후 시장 감시로 구성됩니다.
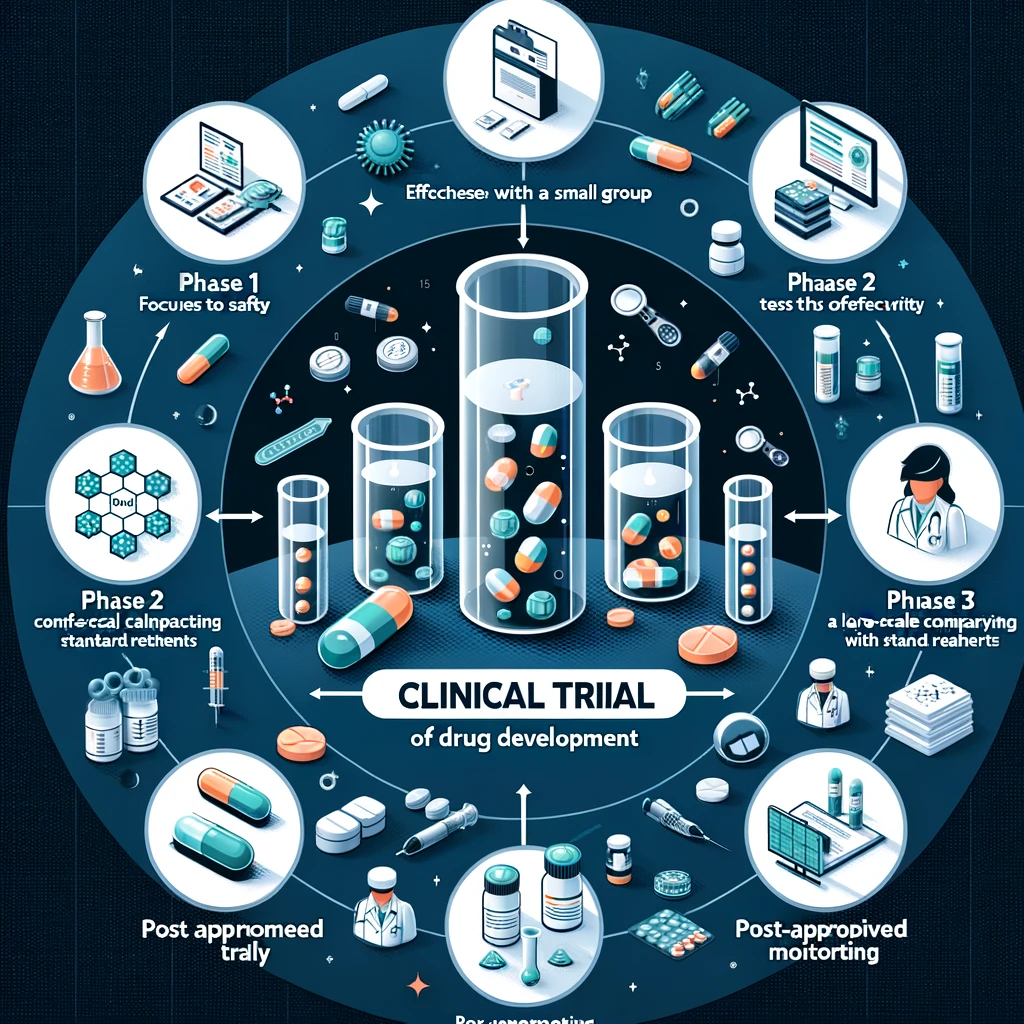
의약품 개발의 임상 단계
1. 사전 연구 단계
의약품 개발은 대개 실험실 연구와 동물 실험으로 시작합니다.
이 단계에서는 약품의 기본적인 특성, 안전성, 대략적인 작용 메커니즘이 평가됩니다.
2. 임상시험 1상 (안전성 평가)
처음으로 사람에게 적용되는 단계로, 주로 건강한 자원자들을 대상으로 합니다.
이 단계의 목적은 약품의 안전성, 부작용, 대사, 배설 과정을 파악하는 것입니다.
3. 임상시험 2상 (효과성 평가)
이 단계는 약품의 효과성과 최적의 용량을 평가합니다.
환자들에게 처음으로 적용되며, 플라시보(가짜 약)와 비교하기도 합니다.
4. 임상시험 3상 (확증 및 비교)
더 많은 환자를 대상으로 하여 약품의 효과성과 안전성을 확증합니다.
이 단계에서는 종종 다른 표준 치료법과의 비교도 이루어집니다.
5. 승인 및 시장 감시
임상시험을 성공적으로 마치면, 제약 회사는 정부 기관에 승인을 요청합니다.
승인 후에는 시장에서 약품의 장기적인 효과와 안전성을 감시합니다.